Loading...
Apakah termodinamika itu? Termodinamika adalah suatu cabang dari ilmu fisika yang mempelajari hubungan antara usaha (energi) dan panas (kalor). Sedangkan menurut bahasa, termodinamika adalah perubahan panas, berasal dari bahasa yunani, thermos = panas dan dynamic = perubahan. Termodinamika ditemukan seiring ditemukannya mesin uap praktis pada dekade 1800-an oleh James Watt.
Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu:
A. Hukum Awal (Zeroth Law/Hukum ke-0)
Bunyi Hukum Termodinamika 0 : "Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain"
B. Hukum Pertama
1. Bunyi Hukum Termodinamika 1 : "Energi tidak dapat diciptakan ataupun dimusnahkan, melainkan hanya bisa diubah bentuknya saja."
2. Rumus/Persamaan 1 Termodinamika:
Q = W + ∆U
Q = kalor/panas yang diterima/dilepas (J)
W = energi/usaha (J)
∆U = perubahan energi (J)
3. Hukum 1 Termodinamika dibagi menjadi empat proses, yaitu
a. Proses Isobarik (tekanan tetap)
Proses isobarik adalah proses perubahan gas dengan tahanan tetap. Pada garis P – V proses isobarik dapat digambarkan seperti pada berikut.
Usaha proses isobarik dapat ditentukan dari luas kurva di bawah gra fik P – V.
b. Proses Isotermis (suhu tetap)
Proses isotermis adalah proses perubahan gas dengan suhu tetap. Perhatikan gra fikk pada Gambar berikut.
Pada proses ini berlaku hukum Boyle.

Karena suhunya tetap maka pada proses isotermis ini tidak terjadi perubahan energi dalam ∆U=O . Sedang usahanya dapat dihitung dari luas daerah di bawah kurva, besarnya seperti berikut.
c. Proses Isokhoris (volume tetap)
Proses isokhoris adalah proses perubahan gas dengan volume tetap. Pada grafik P.V dapat digambarkan seperti pada Gambar berikut.
Karena volumenya tetap berarti usaha pada gas ini nol,

d. Proses Adiabatis (kalor tetap)
Pada proses isotermis sudah kita ketahui, U = 0 dan pada proses isokoris, W = 0. Bagaiaman jika terjadi proses termodinamika tetapi Q = 0 ?
Proses yang inilah yang dinamakan proses adiabatis. Berdasarkan hukum I Termodinamika maka proses adiabatis memiliki sifat dibawah.


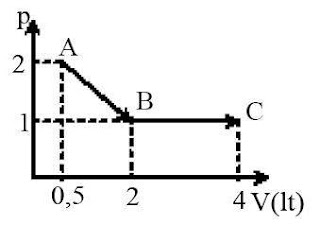
e. Proses Gabungan
Proses-proses selain 4 proses ideal diatas dapat terjadi. Untuk memudahkan penyelesaian dapat digambarkan grafik P – V prosesnya. Dari grafik tersebut dapat ditentukan usaha proses sama dengan luas kurva dan perubahan energi dalamnya
Sedangkan gabungan proses adalah gabungan dua proses adiabatis yang berkelanjutan. Pada gabungan proses ini berlaku hukum I termodinamika secara menyeluruh.
C. Hukum Kedua
Bunyi Hukum Termodinamika 2 : "Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya."
D. Hukum Ketiga
Bunyi Hukum Termodinamika 3 :
"Suatu sistem yang mencapai temperatur nol absolut, semua prosesnya akan berhenti dan entropi sistem akan mendekati nilai minimum."
"Entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol."
Baca Juga:
Pengertian, Klasifikasi, dan Sifat-sifat Sistem Termodinamika
Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu:
A. Hukum Awal (Zeroth Law/Hukum ke-0)
Bunyi Hukum Termodinamika 0 : "Jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam kesetimbangan termal satu sama lain"
B. Hukum Pertama
1. Bunyi Hukum Termodinamika 1 : "Energi tidak dapat diciptakan ataupun dimusnahkan, melainkan hanya bisa diubah bentuknya saja."
2. Rumus/Persamaan 1 Termodinamika:
Q = W + ∆U
Q = kalor/panas yang diterima/dilepas (J)
W = energi/usaha (J)
∆U = perubahan energi (J)
3. Hukum 1 Termodinamika dibagi menjadi empat proses, yaitu
a. Proses Isobarik (tekanan tetap)
Proses isobarik adalah proses perubahan gas dengan tahanan tetap. Pada garis P – V proses isobarik dapat digambarkan seperti pada berikut.
Usaha proses isobarik dapat ditentukan dari luas kurva di bawah gra fik P – V.

b. Proses Isotermis (suhu tetap)
Proses isotermis adalah proses perubahan gas dengan suhu tetap. Perhatikan gra fikk pada Gambar berikut.
Pada proses ini berlaku hukum Boyle.

Karena suhunya tetap maka pada proses isotermis ini tidak terjadi perubahan energi dalam ∆U=O . Sedang usahanya dapat dihitung dari luas daerah di bawah kurva, besarnya seperti berikut.

c. Proses Isokhoris (volume tetap)
Proses isokhoris adalah proses perubahan gas dengan volume tetap. Pada grafik P.V dapat digambarkan seperti pada Gambar berikut.
Karena volumenya tetap berarti usaha pada gas ini nol,

d. Proses Adiabatis (kalor tetap)
Pada proses isotermis sudah kita ketahui, U = 0 dan pada proses isokoris, W = 0. Bagaiaman jika terjadi proses termodinamika tetapi Q = 0 ?
Proses yang inilah yang dinamakan proses adiabatis. Berdasarkan hukum I Termodinamika maka proses adiabatis memiliki sifat dibawah.


e. Proses Gabungan
Proses-proses selain 4 proses ideal diatas dapat terjadi. Untuk memudahkan penyelesaian dapat digambarkan grafik P – V prosesnya. Dari grafik tersebut dapat ditentukan usaha proses sama dengan luas kurva dan perubahan energi dalamnya
Sedangkan gabungan proses adalah gabungan dua proses adiabatis yang berkelanjutan. Pada gabungan proses ini berlaku hukum I termodinamika secara menyeluruh.
C. Hukum Kedua
Bunyi Hukum Termodinamika 2 : "Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya."
D. Hukum Ketiga
Bunyi Hukum Termodinamika 3 :
"Suatu sistem yang mencapai temperatur nol absolut, semua prosesnya akan berhenti dan entropi sistem akan mendekati nilai minimum."
"Entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol."
Baca Juga:
Pengertian, Klasifikasi, dan Sifat-sifat Sistem Termodinamika